lundi, 30 novembre 2020
Comment nos neurones intègrent tous les signaux qui leur parviennent
 J’ai décrit un peu la semaine dernière les circonstances qui ont entouré la mise en évidence progressive de la synapse chimique durant la première moitié du XXe siècle. Et je terminais en disant que je reviendrais plus tard sur d’autres découvertes des années 1950 qui ont enrichi notre compréhension de la communication entre nos cellules nerveuses. C’est donc ce que je ferai aujourd’hui en repartant de la synapse et en exposant brièvement ce que certains ont décrit comme un « exploit remarquable de l’évolution », le fait qu’un neurone soit capable d’intégrer à tout moment la multitude de messages qu’il reçoit des autres neurones et de les retransmettre à d’autres cellules nerveuses.
J’ai décrit un peu la semaine dernière les circonstances qui ont entouré la mise en évidence progressive de la synapse chimique durant la première moitié du XXe siècle. Et je terminais en disant que je reviendrais plus tard sur d’autres découvertes des années 1950 qui ont enrichi notre compréhension de la communication entre nos cellules nerveuses. C’est donc ce que je ferai aujourd’hui en repartant de la synapse et en exposant brièvement ce que certains ont décrit comme un « exploit remarquable de l’évolution », le fait qu’un neurone soit capable d’intégrer à tout moment la multitude de messages qu’il reçoit des autres neurones et de les retransmettre à d’autres cellules nerveuses.
Commençons donc avec Bernard Katz dont j’ai déjà eu l’occasion de parler ici. Katz, c’est l’homme des bulles. Pas de champagne cependant, mais ces petites bulles, ou plutôt vésicules, qu’il a découvertes et qui contiennent les neurotransmetteurs. En utilisant les nouvelles techniques du début des années 1950 permettant d’enregistrer avec de petites électrodes le potentiel de membrane des cellules, Katz va examiner attentivement la jonction neuromusculaire de la grenouille pour s’apercevoir que les neurotransmetteurs ne sont pas relâchés comme on le pensait de manière continue mais par petits paquets.
Quelques années plus tard, vers le milieu des années ’50 le développement de la microscopie électronique, qui va avoir une bien meilleure résolution que la microscopie optique, va permettre d’observer toute la morphologie de la synapse, y compris ces vésicules synaptiques contenant les neurotransmetteurs tout au bout de l’axone. Et c’est comme ça, après encore bien d’autres expériences, qu’on en est venu à avoir une image de plus en plus précise de la synapse, telle qu’on peut la voir aujourd’hui dans tout bon textbook de neuroscience.
C’est-à-dire, si on y va à grand trait, le bouton terminal de l’axone où sont stocké les vésicules remplies de neurotransmetteurs, qu’on appelle souvent la partie « présynaptique » de la synapse; et la dendrite du neurone post-synaptique avec, fiché dans sa membrane cellulaire vis-à-vis l’axone, des grosses protéines qu’on appelle des récepteurs. Lorsque l’influx nerveux arrive au bout de l’axone, il va faire entrer des ions calcium qui vont amener les vésicules synaptiques à fusionner avec la membrane du bout de l’axone, libérant dans la fente synaptique les neurotransmetteurs. Ceux-ci vont immédiatement se fixer sur les récepteurs de l’autre côté de la fente sur le neurone post-synaptique. Cette fixation va provoquer une déformation de la protéine récepteur qui va créer en son centre une ouverture à travers laquelle des ions sodiums vont passer pour entrer à l’intérieur de la cellule. Ou alors parfois la fixation du neurotransmetteur va faire se déformer la protéine qui va activer une ou d’autres protéines qui vont faire ouvrir un canal au sodium. Mais que l’ouverture du canal soit directe ou indirect, dans les deux cas ça commence avec la fixation du neurotransmetteur, un peu comme une clé dans une serrure, et ça finit par l’entrée d’ions sodium.
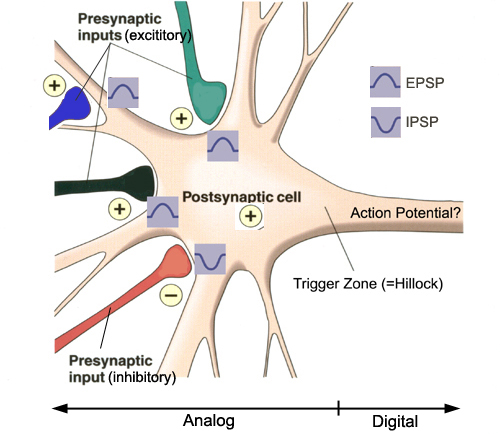
Les dendrites, ou plutôt les épines dendritiques, qui sont des petits renflements sur les dendrites où arrive l’axone, ne possèdent pas les canaux dépendant du voltage qui font que l’influx nerveux peut se déclencher et se propager comme sur l’axone. Ils ont d’autres types de canaux, comme ceux que je viens de décrire par exemple qui vont laisser entrer du sodium quand la molécule de neurotransmetteur se fixe dessus. Mais ces canaux-là vont pas s’emballer comme les autres parce qu’ils ne sont pas sensibles au voltage. Alors ce que ça va produire dans le neurone post-synaptique, c’est une petite dépolarisation qui va élever le potentiel de membrane de quelques millivolts ou quelques dizaines de millivolts, mais qui va perdre son intensité avec la distance. C’est ça la grande différence d’avec le potentiel d’action.
Pour comprendre quand l’influx nerveux va pouvoir se propager dans le neurone suivant, il va falloir expliquer comment le neurone intègre constamment tous les messages qu’il reçoit. Parce qu’un neurone peut recevoir des milliers de connexion sur ses dendrites et son corps cellulaire en provenance d’autres neurones. Et comme je viens de l’évoquer, les variations du potentiel de membrane provenant de l’activité nerveuse à toutes ces synapses vont se propager à partir de leur source, mais en perdant de l’intensité avec la distance. Ça veut dire qu’à mesure que ces variations du potentiel de membrane se propagent, elles vont pouvoir s’additionner ou se soustraire mutuellement. Car on l’a évoqué rapidement en parlant de Eccles la semaine dernière, mais il est important de garder à l’esprit que tous les neurotransmetteurs ne vont pas exciter le neurone postsynaptique en dépolarisant sa membrane, comme le fait le glutamate par exemple. D’autres comme le GABA vont au contraire rendre le potentiel de membrane encore plus négatif, l’éloignant donc du seuil de déclenchement du potentiel d’action. Bref, certaines synapses sont dites inhibitrices et vont rendre le neurone moins excitable.
Ces excitations et ces inhibitions que reçoit le neurone à tout moment vont donc s’additionner et se soustraire, mais ce qui va déterminer si un autre influx nerveux va repartir dans le second neurone c’est le niveau du potentiel de membrane à un endroit très précis : le tout début de l’axone qui part du corps cellulaire. Cet à cet endroit que les canaux ioniques qui se trouvent dans la membrane vont changer pour devenir les canaux dépendants du voltage typiques de l’axone. Et donc si la somme des potentiels excitateurs et inhibiteurs en provenance de toutes les synapses du neurone est supérieure à cet endroit précis au seuil de déclenchement de l’influx nerveux, autour de – 55 à – 50 millivolts, alors un potentiel d’action va être généré. Et il va s’en aller de manière tout ou rien jusqu’au bout de l’axone.
On voit donc comment la « décision », entre guillemets, d’émettre ou non un influx nerveux va dépendre à chaque instant de tout ce que le neurone est en train de recevoir en termes d’excitation ou d’inhibition partout sur ses dendrites et son corps cellulaire. Si on se replace dans notre chronologie des découvertes fondatrices à propos du neurone et de la synapse, on a commencé à comprendre comment cette intégration se faisait vers la fin des années 1950. En particulier avec les travaux de l’américain Wilfrid Rall qui ont permis de calculer les courants électriques qui diffusent passivement dans les dendrites.
Comme les embranchements du réseau dendritique d’un neurone sont généralement bien complexes, c’est loin d’être évident de figurer comment les courant vont diffuser là-dedans. Mais grâce à la « théorie des câbles » de Rall, des estimations peuvent être faites en modélisant les dendrites comme des cylindres de différents diamètres. Chaque cylindre possède alors une résistance électrique, due au cytoplasme, et une capacitance électrique, associée à la membrane cellulaire. Ces deux propriétés électriques de base permettent comme ça d’inférer la diffusion du courant dans chaque section et d’avoir une bonne idée de ce qui va se rendre jusqu’à la zone gâchette. Et donc de produire ou pas un influx nerveux.
C’est comme ça qu’on a pu distinguer des phénomènes de base de l’intégration neuronale. Ce qu’on appelle par exemple la sommation temporelle, quand deux stimuli arrivent à une même synapse très vite l’un après l’autre. La dépolarisation causée par le premier ne s’est pas encore estompée quand le deuxième arrive, qui embarque en quelque sorte par-dessus, ce qui augmente les chances d’atteindre le seuil de déclenchement du potentiel d’action.
Ou bien ce qu’on appelle la sommation spatiale qu’on a un peu décrit tantôt, c’est-à-dire le fait qu’à un moment donné, il y a des excitations ou des inhibitions qui arrivent en même temps mais à différents endroits sur les dendrites ou le corps cellulaire, et que tout ça va s’additionner ou se soustraire au fur et à mesure de leur diffusion le long de la membrane. Et donc il faut voir le potentiel de membrane d’un neurone comme quelque chose de dynamique qui fluctue constamment au gré des excitations et des inhibitions qu’un neurone reçoit. Et produisant un potentiel d’action chaque fois que ce potentiel de membrane dépasse le seuil au niveau de la zone gâchette de l’axone.
En plus, et je terminerai là-dessus, ça veut dire que les dendrites d’un seul neurone peuvent effectuer des opérations logiques de base comme ET, OU, NON-ET, etc. Prenons seulement les deux exemples précédents de sommation temporelle ou spatiale qui réussissent à produire un influx nerveux. Ça peut être vu comme une fonction logique ET dans le sens où, dans une fenêtre temporelle donnée, ça prend l’activation de telle synapse ET de telle autre pour que le neurone réponde. On peut aussi qualifier ce type de computation de « détecteur de coïncidence ».
Un peu de la même façon, si l’on a un neurone dont les influx nerveux sont déclenchés suite à l’activation de synapses sur telle dendrite OU telle autre, on a ce qu’il faut pour implémenter la fonction logique OU. Et on peut en imaginer d’autres, qui combinent différents événements sur les dendrites. Par exemple si l’on a une synapse inhibitrice située sur la voie d’une excitation suffisante pour provoquer le déclenchement d’un influx nerveux, mais que cette inhibition est assez forte pour l’empêcher, on a ici comme un veto possible de cette connexion inhibitrice si elle est active. Ces capacités de calcul des neurones ont grandement alimenté les analogies entre le cerveau est les ordinateurs, pour le meilleur, et surtout pour le pire.
Tout ça pour dire que la quantité d’influx nerveux que va émettre un neurone pendant un certain temps reflète ce qui s’est passé dans son réseau dendritique durant cette période. Et donc ce nombre de potentiel d’action par unité de temps, une seconde par exemple, est porteur d’information. Le taux de décharge d’un neurone, comme on l’appelle, est donc un des véhicules principaux dont disposent les neurones pour s’échanger de l’information. On a beaucoup mis l’accent là-dessus dans les décennies qui ont suivi la mise en évidence de l’intégration neuronale, mais on sait maintenant que les neurones peuvent s’échanger de l’information par d’autres stratégies, notamment en créant des oscillations dans leur activité et en synchronisant ces cycles avec d’autres neurones. Mais ça, c’est une autre histoire…
Non classé | Comments Closed